Die Entwicklung spektroskopischer Verfahren und damit der Funkenspektroskopie ist stark mit den Arbeiten bedeutender Personen verbunden:
Isaac Newton
Im 17. Jahrhundert ließ der Brite Isaac Newton durch einen Spalt zwischen zwei Brettern Sonnenlicht auf ein Prisma (Glaskeil) fallen. Er wunderte sich, da das weiße Sonnenlicht hinter dem Prisma ein farbiges Band auf seiner Zimmerwand erscheinen ließ, in dem sich die Regenbogenfarben mit unterschiedlich gebrochenem Strahl widerspiegelten. Aha, fragte er sich, lässt sich dieser Effekt auch wieder rückgängig machen? Er ließ folglich die Regenbogenfarben durch ein zweites Prisma fallen. Hinter diesem erschien wieder ein weißer Strahl. Newton zog den Schluss: Das weiße Licht ist aus Strahlen unterschiedlicher Farben zusammengesetzt.
William Hyde Wollaston
Anfang des 19. Jahrhunderts führte William Hyde Wollaston Newtons optische Sonnenexperimente fort und verwendete immer kleinere Spalte, durch die das Sonnenlicht einfiel. Er bemerkte innerhalb der Regenbogenfarben dunkle, schmale Bereiche, in denen keine Farbe erschien. Seinen Entdeckungen wurde in der Öffentlichkeit jedoch keine Aufmerksamkeit geschenkt.
Joseph von Fraunhofer
Anfang des 19. Jahrhunderts entwickelte Joseph von Fraunhofer ein Beugungssgitter mit Furchen von 0,003 mm Abstand. Dieses Gitter arbeitete ähnlich wie ein Prisma, spaltete also weißes Licht in örtlich getrennte Farben auf. Es erreichte aber eine verbesserte Auflösung der unterschiedlichen Farben. Im Jahr 1814 führte er Wollastons Arbeiten fort und beschrieb die nach ihm benannten Fraunhoferschen Linien im Sonnenspektrum.
John Herschel
John Herschel untersuchte das Verhalten unterschiedlicher Salze in Flammen. Er beobachtete 1832 verschiedene Farben, die er für Experimente nutzte.
Bunsen & Kirchhoff
 Robert Wilhelm Bunsen arbeitete wie Herschel ebenfalls mit Flammenfärbungen. Bunsen und Gustav Robert Kirchhoff entdeckten und erklärten 1859 die Reversibilität von Emissionslinien. Diese drückt sich im ersten Strahlungssatz aus: „Jeder Körper absorbiert unter Anregung diejenige Strahlungsart, die er dann auch emittiert.“. Damit konnten die Fraunhoferschen Linien als Absorptionslinien von Gasen (Wasserstoff) identifiziert werden. Sie erklärten damit auch die Ursache von Herschels Flammenfärbungen als charakteristische Eigenschaft der in der Flamme verdampften Atome. Durch ihre Publikationen wurde der Grundstein für die qualitative Spektralanalyse gelegt, die den Nachweis chemischer Elemente gestattete.
Robert Wilhelm Bunsen arbeitete wie Herschel ebenfalls mit Flammenfärbungen. Bunsen und Gustav Robert Kirchhoff entdeckten und erklärten 1859 die Reversibilität von Emissionslinien. Diese drückt sich im ersten Strahlungssatz aus: „Jeder Körper absorbiert unter Anregung diejenige Strahlungsart, die er dann auch emittiert.“. Damit konnten die Fraunhoferschen Linien als Absorptionslinien von Gasen (Wasserstoff) identifiziert werden. Sie erklärten damit auch die Ursache von Herschels Flammenfärbungen als charakteristische Eigenschaft der in der Flamme verdampften Atome. Durch ihre Publikationen wurde der Grundstein für die qualitative Spektralanalyse gelegt, die den Nachweis chemischer Elemente gestattete.
H. A. Rowland
Henry Augustus Rowland verbesserte 1882 die Herstellung von Reflexionsgittern und fertigte ein Konkavgitter. Spektrometer mit Rowland-Gittern benötigen keine Linsen zur Fokussierung. Das einzige optische Element ist das Konkavgitter. Eintrittsspalt, Gitter und Beobachtungs-(Detektions-) ebene liegen auf einem Kreis, dem Rowlandkreis.
F. Paschen & C. Runge
Der Physiker Friedrich Paschen und der Mathematiker Carl Runge verwendeten Rowlands Erkenntnisse und entwickelten Anfang des 20. Jahrhunderts die heute verbreitete Spektrometeraufstellung bei Polychromatoren (Paschen-Runge-Aufstellung).
Spektroskope und Spektrometer
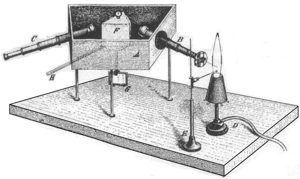
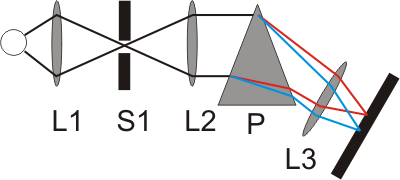
Erste spektroskopische Apparate zur Beobachtung von Sonnen- und Flammenspektren bestanden aus Eintrittsspalt, Linsen, Prisma und einem Beobachtungsschirm. Das Licht des Eintrittsspaltes S1, einem schmalen Schlitz, wurde durch das verwendete Prisma P in die unterschiedlichen Wellenlängen aufgespalten. Mit Hilfe von Linsen (L1 bis L3) wurden diese Wellenlängen auf einen Schirm fokussiert, auf dem mehrere farbige Bilder des Eintrittsspaltes zu erkennen waren: die Emissionslinien.
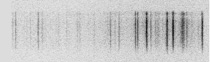
 Nachdem die Emissionsspektren zunächst lediglich mit dem Auge beobachtet wurden, verwendete man später Photoplatten, die auf der Fokalebene des Spektroskops montiert wurden. Durch das eintreffende Licht wurden sie belichtet. Die Intensität der Emissionslinien konnten durch einen unterschiedlichen Grad der Schwärzung detektiert werden. Aus den anfänglichen spektroskopischen Apparaturen wurde ein Spektrometer, ein Gerät, mit dem sich die qualitative und quantitative Zusammensetzung des untersuchten Materials bestimmen ließ. Dies wird auch durch die Bezeichnung des Verfahrens deutlich gemacht: Bei Geräten auf Grundlage von quantitativen Bestimmungsmethoden spricht man von Spektrometern. Auf der Photoplatte lässt sich gut erkennen, warum sich die Bezeichnung „Linienspektren“ verbreitet hat.
Nachdem die Emissionsspektren zunächst lediglich mit dem Auge beobachtet wurden, verwendete man später Photoplatten, die auf der Fokalebene des Spektroskops montiert wurden. Durch das eintreffende Licht wurden sie belichtet. Die Intensität der Emissionslinien konnten durch einen unterschiedlichen Grad der Schwärzung detektiert werden. Aus den anfänglichen spektroskopischen Apparaturen wurde ein Spektrometer, ein Gerät, mit dem sich die qualitative und quantitative Zusammensetzung des untersuchten Materials bestimmen ließ. Dies wird auch durch die Bezeichnung des Verfahrens deutlich gemacht: Bei Geräten auf Grundlage von quantitativen Bestimmungsmethoden spricht man von Spektrometern. Auf der Photoplatte lässt sich gut erkennen, warum sich die Bezeichnung „Linienspektren“ verbreitet hat.
 Man fand heraus, dass bei der Funkenspektrometrie viele bedeutende Emissionslinien außerhalb des sichtbaren im angrenzenden UV-Bereich bis 200 nm erscheinen. Photoplatten können im Gegensatz zum menschlichen Auge diesen Bereich detektieren. Die Spektrometer wurden daher mit UV-durchlässigen optischen Komponenten (Quarzglas) ausgestattet.
Man fand heraus, dass bei der Funkenspektrometrie viele bedeutende Emissionslinien außerhalb des sichtbaren im angrenzenden UV-Bereich bis 200 nm erscheinen. Photoplatten können im Gegensatz zum menschlichen Auge diesen Bereich detektieren. Die Spektrometer wurden daher mit UV-durchlässigen optischen Komponenten (Quarzglas) ausgestattet.
Unterhalb von etwa 200 nm absorbiert Luft die Strahlung. Die Spektrometer mussten mit Hilfe einer Vakuumpumpe evakuiert oder mit einem transparenten gasförmigen Medium gefüllt werden (Argon oder Stickstoff). Im sogenannten Vakuum-UV wurden wichtige Emissionslinien für P, S, N, O und C zugänglich. Somit war der heute genutzte Wellenlängenbereich von 110 bis 800 nm gefunden.
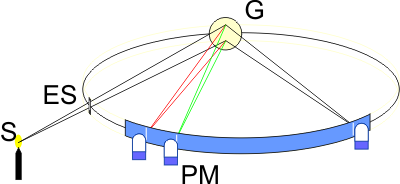 Der Amerikaner H. A. Rowland machte Ende des 19. Jahrhunderts eine interessante Entdeckung. Fertigt man ein Dispersionsgitter (G) auf einer konkaven, spiegelnden Oberfläche, so erhält dieses Gitter zwei wichtige Eigenschaften: Es dispergiert erstens das einfallende Licht nach Wellenlänge und fokussiert das Bild des Eintrittsspaltes (ES). Montiert man Gitter und Eintrittsspalt auf einer Kreisbahn, so werden alle Wellenlängen ohne zusätzliches optisches Element auf dieser Kreisbahn abgebildet (Rowland Kreis). Dieser Aufbau hat Vorteile bezüglich Wellenlängenstabilität und Lichtausbeute. Die Lichtausbeute lässt sich weiterhin durch die Verwendung holografisch geblazter Gitter steigern. Heute werden nahezu ausschließlich Gitter als dispergierendes Element in Emissionsspektrometern verwendet. In der Funkenspektrometrie hat sich die Verwendung von Rowland-Gittern mit der sogenannten Paschen-Runge-Anordnung etabliert.
Der Amerikaner H. A. Rowland machte Ende des 19. Jahrhunderts eine interessante Entdeckung. Fertigt man ein Dispersionsgitter (G) auf einer konkaven, spiegelnden Oberfläche, so erhält dieses Gitter zwei wichtige Eigenschaften: Es dispergiert erstens das einfallende Licht nach Wellenlänge und fokussiert das Bild des Eintrittsspaltes (ES). Montiert man Gitter und Eintrittsspalt auf einer Kreisbahn, so werden alle Wellenlängen ohne zusätzliches optisches Element auf dieser Kreisbahn abgebildet (Rowland Kreis). Dieser Aufbau hat Vorteile bezüglich Wellenlängenstabilität und Lichtausbeute. Die Lichtausbeute lässt sich weiterhin durch die Verwendung holografisch geblazter Gitter steigern. Heute werden nahezu ausschließlich Gitter als dispergierendes Element in Emissionsspektrometern verwendet. In der Funkenspektrometrie hat sich die Verwendung von Rowland-Gittern mit der sogenannten Paschen-Runge-Anordnung etabliert.
Die bis etwa 1950 übliche Verwendung von Photoplatten als Detektor gestattete die Aufnahme des kompletten Emissionsspektrums. Photoplatten sind hochempfindlich und ermöglichen die Erkennung kleinster Lichtmengen. Daneben ist der Analysenprozess aufwendig, da pro Messung eine Photoplatte entwickelt werden muss. Eine schnelle Produktionskontrolle war so nicht möglich. Ab etwa 1950 fanden Photomultiplier (PM) Verwendung. Ein PM erzeugt aus einfallenden Photonen Elektronen und verstärkt diese. Das Emissionsspektrum kann mit Hilfe nur eines PMs erfasst werden (scannender Monochromator). Alternativ können an alle interessierenden Wellenlängenpositionen Austrittsspalte montiert werden. Hinter jedem Austrittsspalt befindet sich dann ein für den Wellenlängenbereich optimaler Photomultiplier. Die resultierenden Photoströme werden in Kondensatoren integriert und erzeugen eine Spannung, die der einfallenden Lichtmenge proportional ist. Die elektronischen Signale können sofort verarbeitet werden. Die Messgrößen werden digital angezeigt. Nach Einzug der Computertechnik wurden alle Messgrößen in Konzentrationen umgerechnet und auf dem Bildschirm ausgegeben. Für eine Routineanalyse wurde somit eine schnelle und präzise Detektionsart über den kompletten Wellenlängenbereich geschaffen. Photomultiplier-Systeme gestatten die simultane Erfassung einer Vielzahl von Elementkanälen, die aber bei der Fertigung des Spektrometers festgelegt werden müssen.
In den vergangenen Jahren wurden die elektronischen Komponenten unter Zuhilfenahme der Halbleiter verbessert und verkleinert. So werden heute halbleitergesteuerte Anregungsgeneratoren ohne Verschleißteile verwendet. Die Funkenspektrometrie hat sich als bedeutende Qualitätskontrolle bei der Herstellung von Metallen und Legierungen etabliert. Hier gibt es seit etwa 20 Jahren starke Bestrebungen, den Analysenprozess mit Probenvorbereitung, Probentransport, Analyse und Ergebnisweiterleitung zu automatisieren. Auch der Spektrometerstatus wird mehr und mehr durch intelligente Funktionen selbstständig kontrolliert.
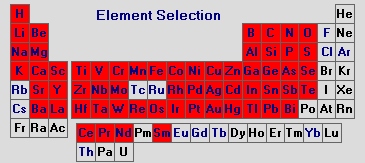 Mit Hilfe der Funkenspektrometrie lassen sich die in der nachfolgenden Abbildung markierten Elemente bis herunter zu Konzentrationen von einigen µg/kg analysieren.
Mit Hilfe der Funkenspektrometrie lassen sich die in der nachfolgenden Abbildung markierten Elemente bis herunter zu Konzentrationen von einigen µg/kg analysieren.
Weiterlesen »

